Aperçu des sections
- Généralités
- Chap II DOSAGE ACIDO-BASIQUE
Chap II DOSAGE ACIDO-BASIQUE
Doser une solution c’est déterminer sa concentration
I. Dosage d’un acide fort par une base forte
1. Caractéristiques de la réaction
La réaction entre une base forte et un acide fort est totale et exothermique
2. 2. Equivalence acido-basique
Il y a équivalence acido-basique pour un mélange d’acide fort de volume VA de concentration CA et de base forte de volume VB, de concentration CB lorsque
n(H3O+) = n(HO-) ⇒CA. VA = CB. VBE
Le pH d’un mélange d’acide fort et de base forte à l’équivalence est égal à pH=7
3. Dosage pH-métrique
Exemple : On dose une solution de HCl de volume VA = 20cm3 de concentration inconnue CA avec de la soude de concentration CB= 10-1 mol.L-1.· Dispositif expérimental :
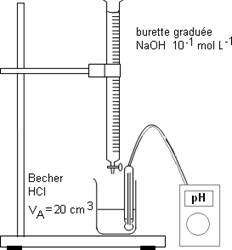
· Courbe de dosage
VB cm3
0
4
8
12
16
18
19,8
20
20,2
22
30
40
pH
1,1
1,2
1,4
1,6
2
2,3
3,3
7
10,7
11,7
12,3
12,5
Traçons la courbe de dosage pH = f(VB)
Echelle :1 carreau ↔1pH 1carreau↔ 4 cm3
· Courbe de dosage
On observe un saut de pH au voisinage de l’équivalence
Le point E est un point d’inflexion déterminé par la méthode des tangentes
· Utilisation d’un indicateur coloré : il faut que la zone de virage de l’indicateur coloré encadre la valeur du pH à l’équivalence
Exemple : BBT 6,2< pH (E)=7<7,6
II. Dosage d’un acide faible par une base forte
1. Caractéristiques de la réaction
C’est une réaction presque totale, rapide et moins exothermique que la réaction entre un acide fort et une base forte.
2. 2. Equivalence acido-basique
n(H3O+) = n(HO-) ⇒ CAE. VAE = CBE. VBE
A l’équivalence le pH du mélange est basique pH>7
3. Dosage pH-métrique
Exemple : On dose 20 cm3 d’acide acétique CH3COOH avec une solution de soude à 10-1 mol.L-1
· Dispositif expérimental
VB cm3
0
2
6
10
14
18
19,5
20
20,5
22
26
30
pH
2,8
3,7
4,3
4,7
5,1
5,7
6,3
8,7
11,1
11,7
12,1
12,3
Traçons la courbe de dosage pH = f(VB)
Echelle : 1carreau ↔1pH 1carreau ↔ 2 cm3

A la demi-équivalence,
et pH = pKA, il y a effet tampon.
Calcul du pH d’une solution
· pH = - log [H3O+] ⇒ [H3O+] = 10 –pH
· Produit ionique de l’eau H2O + H2O
H3O+ + HO-
|H3O+ ]. [ HO-] = Ke = 10-14
· Pour une solution d’acide fort de concentration molaire Ca (1,5 <pH<6)
[H3O+] = n.CA ⇒ pH = -log (nCA)
n=1 pour un monoacide, 2 pour un diacide ….
· Pour une solution de base forte de concentration CB ( 8<pH <12.5)
[HO-] = n.CB ⇒ pH =14 + log(nCb)
n =1 pour une monobase, 2 pour une dibase….
· Pour une solution d’acide ou de base faible de couple A/B A : acide
B : base conjugué
pH = pKA+ log

pKA = - logKA
KA = [H3O+].

Facteur d’ionisation
α =


Mr RANDRIANANTENAINA Chabanas Deloy
Email: deloychabanas@gmail.com
