CLASSIFICATION PERIODIQUE DES ELEMENTS CHIMIQUES
CLASSIFICATION PERIODIQUE DES ELEMENTS
I. Principe de la classification
La classification périodique simplifiée est présenté sous forme d’un tableau contenant 4 lignes et 8 colonnes.
Les lignes sont numérotées de haut en bas.
Les colonnes sont numérotées de gauche à droite.
Les éléments sont classés par ordre atomique croissant le long d’une ligne de gauche à droite.
Pour les éléments de la 1ère ligne, les électrons occupent la couche K (n=1) seulement.
La 2ème ligne correspond au remplissage des couches Ket L par les électrons.
Pour les éléments de 3ème ligne, les électrons occupent les couches K, L et M.
On constate que le numéro de la ligne correspond au nombre des couches occupées par les électrons.
|
Numéro de la ligne |
Nombre de couches occupées par les électrons |
|
1 2 3 4 |
1 2 3 4 |
La 1ère colonne regroupe des éléments qui possèdent tous un électron sur leur couche périphérique.
Exemples :
1H : (K)1
3Li : (K)2(L)1
La 2ème colonne regroupe des éléments qui possèdent chacun 2 électrons sur la couche externe. Exemples :
4Br : (K)2(L)2
12Mg: (K)2(L)8(M)2
La 7ème colonne regroupe des éléments qui ont tous 7électrons sur la couche externe.
Exemple :
17Cl : (K)2(L)8(M)7
9F : (K)2(L)7
La 8ème colonne regroupe des éléments ayant 8 électrons sur la couche externe, hormis l’hélium qui a sa couche K complète avec un doublet d’électrons.
Le numéro de chaque colonne correspond au nombre des électrons sur la couche externe.
|
Numéro de la colonne |
Nombre d’électrons périphériques |
|
I II II IV V VI VII VIII |
1 2 3 4 5 6 7 8 |
Remarque:
La classification périodique est composée de 7 lignes et de 18 colonnes.
Les éléments sont classés par ordre atomique croissant le long d’une ligne.
La classification regroupe des éléments naturels ou artificiels et a été établie par le chimiste Russe Mendeleïev en 1869 :
-les lignes sont appelées périodes et les colonnes groupes.
-l’extrait du tableau ne présente que les 20 premiers éléments.
II. Repérage d’un élément à partir des couches occupées par les électrons
- Si l’élément X possède 3 couches occupées par des électrons, elle se trouve sur la 3ème période.
-Si l’élément X a 3électrons sur sa couche externe, il se trouve dans le 3ème groupe.
L’élément appartient donc à la 3ème période et au 3ème groupe.
-Si l’élément X’a 3électrons périphériques, il se trouve dans le 3ème groupe.
-L’élément X’’ se trouve dans la 2ème période et 6ème groupe. Cet élément est l’oxygène 8O : (K)2(L)6
III. Caractéristiques des éléments de quelques familles
1. Les éléments du groupe I
Les éléments H, Li, Na, K sont caractérisés par la présence d’un seul électron sur la couche externe et des propriétés physiques et chimiques semblables. Ce sont des corps simples métalliques, mous et peu denses mis à part l’hydrogène.
2. Les éléments du groupe II
Les éléments Be, Mg, Ca du groupe II sont caractérisés par la présence de 2électrons sur la couche externeet de propriétés physiques semblables.Ils constituent la famille des alcalino-terreux.
. Les éléments du groupe VII
Les éléments F, Cl sont caractérisés par la présence de 7électrons sur la couche externe et une propriété chimique semblable (grande réactivité).Ce sont des corps simples diatomiques qui constituent la famille des halogènes.
4. Les éléments du groupe VIII
Ils sont caractérisés par la présence de 8 électrons sur leur couche externe, à l’exception de l’hélium et des propriétés physiques et chimiques semblables. Ce sont des corps simples monoatomiques, gazeux à la température ordinaire. On dit qu’ils forment la famille des gaz rares.
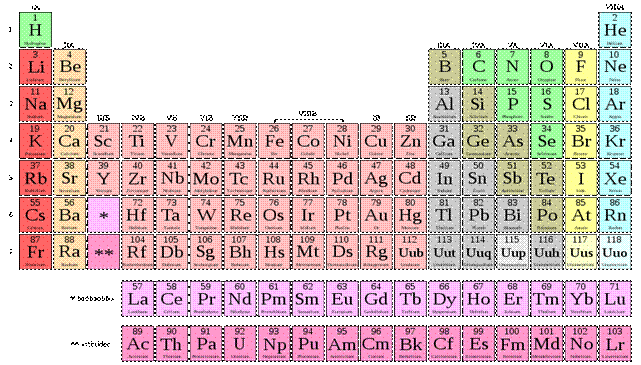
Bibliographie :
COQ,C.,(1987) Chimie 2nde, Collection Guy Martin.
https://upload.wikimedia.org/wikipedia/commons/thumb/5/51/Tableau_periodique_Z_et_nom_fr.svg/771px-Tableau_periodique_Z_et_nom_fr.svg.png

CONCEPTEURS MEN
