Themen dieses Kurses
- Allgemeines
- Chap II LES ALCOOLS
Chap II LES ALCOOLS
LES ALCOOLS
1. 1- Généralités
a) a) Définition
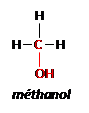
Un alcool est caractérisé par le groupement hydroxyle – OH porté par un carbone tétragonal.
Exemple : méthanol CH3OH
b) b) Classe d’un alcool
Alcools
Alcool primaire (I)
Alcool secondaire (II)
Alcool tertiaire (III)
Définition
Le carbone fonctionnel porteur du groupe hydroxyle – OH est lié à deux atomes d’hydrogène et à un seul atome de carbone.
Le carbone fonctionnel porteur du groupe hydroxyle – OH est lié à un seul atome d’hydrogène et à deux atomes de carbone.
Le carbone fonctionnel porteur du groupe hydroxyle – OH n’est lié à aucun atome d’hydrogène et à trois atomes de carbone.
Exemple

Exception :


2. 2- Synthèse des alcools
a) a) Synthèse des alcools par fermentation des sucres :
C’est une réaction biochimique à l’abri de l’air des sucres fermentescibles. Ils sont transformés en éthanol et dioxyde de carbone en présence des enzymes qui jouent le rôle d’un catalyseur.
Exemple : glucose C6H12O6
C6H12O6 →2CO2 + 2CH3CH2OH
b) b) Synthèse des alcools par hydratation des alcènes :
L’hydratation d’un alcène conduit à un alcool.
CnH2n + H2O → CnH2n+1OH
Exemples : CH2=CH2 + H2O→ CH3 – CH3
Ethylène éthane
H3C – CH2 – CH = CH2 + H2O→H3C – CH2 – CH2 – CH2OH + H3C – CH2 – CHOH – CH3but-1-ène butan-1-ol butan-2-ol
Règle de MARKONIKOV : Au cours d’une réaction d’addition, l’atome d’hydrogène se fixe de façon prépondérante sur l’atome de carbone le plus hydrogéné.
3- 3- Réactivité
a) a) Déshydratation d’un alcool :
v Chauffé en présence d’un catalyseur puissant : alumine Al2O3, l’alcool peut se déshydrater en alcène.
Exemple : H3C – CH2OH
 CH2=CH2 + H2O
CH2=CH2 + H2OEthanol éthylène
v Formation d’éther oxyde :
H3C – CH2OH + OHCH2 – CH3
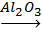 H3C – CH2 – O – CH2
– CH3 + H2O
H3C – CH2 – O – CH2
– CH3 + H2OEthanol éthanol oxyde de diéthyle
b) b) Réaction ave le sodium :
L’alcool pur réagit avec le sodium pour donner un dégagement de dihydrogène et de l’alcanolate de sodium.
Exemple : H3C – CH2OH + Na → H3C – CH2 – O – Na +
 H2
H2Ethanol éthanolate de sodium
c) c) Oxydation ménagée des alcools :
Alcools primaires
Alcools secondaires
Alcools tertiaires
Produit par oxydation
Aldéhydes (oxydant en défaut)
Acides carboxyliques (oxydant en excès)
Cétones
Pas de réaction
Identification des produits
Positif (+) avec 2,4 -DNPH, réactif de Schiff, réactif de Tollens, liqueur de Fehling
Positif (+) avec 2,4- DNPH
Négatif (-) avec réactif de Schiff, réactif de Tollens, liqueur de Fehling
Remarque :
2,4-DNPH (2,4 – dinitrophénylhydrazine)

Réactif de Tollens (nitrate d’argent ammoniacal)
[Ag (NH3)2]2+,NO3-
d) Synthèse d’un ester à partir d’un alcool :
La réaction entre un acide carboxylique et un alcool conduit à un ester et de l’eau. C’est l’estérification.
Acide carboxylique + alcool ⇄ ester + eau
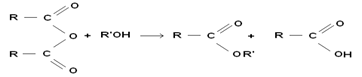
R-COOH + R’OH ⇄ RCOOR’ + H2O
C’est une réaction lente, athermique (ni exothermique, ni endothermique), réversible et limitée par la réaction inverse (Hydrolyse d’un ester) : lés deux réactions se produisent en même temps jusqu’à un état d’équilibre chimique.
v - Rendement d’estérification :
Taux d’acide estérifié =
 *100
*100(%)
Taux d’alcool estérifié =
 *100
*100(%)
v - Facteur influençant l’équilibre :
- L’élévation de température ou l’utilisation d’un catalyseur permet d’atteindre plus rapidement la limite d’équilibre mais n’améliore pas le rendement.
- Des études expérimentales sur des mélanges équimolaires (nacide = nalcool) montrent que le rendement dépend de la classe d’alcools utilisés
Alcool I : 67% Alcool II : 60% Alcool III : 5%
- On peut améliorer le rendement en ajoutant au fur et à mesure de l’acide ou bien de l’alcool.
- En particulier, les réactions d’estérification suivantes sont rapides, exothermiques et presque totales.
Chlorure d’acyle + alcool →ester + chlorure d’hydrogène
RCOOCl + R’OH → RCOOR’ + HCl
Anhydride d’acide + alcool → ester + acide carboxylique

Mr RANDRIANANTENAINA Chabanas Deloy
e mail: deloychabanas@gmail.com
