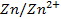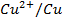LES PILES ELECTROCHIMIQUES
LES PILES ELECTROCHIMIQUES
I. Pile Zinc/Cuivre ou Pile Daniell
1. Description
Cette pile est constituée des éléments suivants :
ü Une lame de zinc plongée dans une solution de sulfate de zinc.
ü Une lame de cuivre plongée dans une solution de sulfate de cuivre.
ü Un pont salin ou pont ionique composé d’un électrolyte de chlorure de potassium (KCl) permettant la circulation des ions ne participant pas aux réactions chimiques se produisant dans la pile.
Les lames métalliques sont appelées électrodes. L’ensemble constitué par une électrode plongeant dans une solution de cation Mn+ du même métal forme une demi-pile.
L’ensemble des deux demi-piles reliées par le pont salin constitue une pile dont les bornes sont les électrodes métalliques.
Par convention, on représente une pile Daniell selon le schéma :
|
|
 |
|
|
Lame /solution |
(PONT SALIN) |
solution/ lame |
2. Etude expérimentale
Réalisons la pile Daniell. Prenons :
- Deux béchers contant respectivement une solution de sulfate de cuivre(II) 0,1mol.L-1 et une solution de sulfate de zinc (II) 0,1mol.L-1.Dans le premier bécher, introduisons une lame de cuivre et dans le deuxième bécher une lame de zinc.
- Relions les deux solutions par une bande de papier imbibée de solution de chlorure de potassium KCl (pont ionique).
- Relions les deux électrodes par un circuit extérieur comportant un milliampèremètre. Un courant électrique de faible intensité circule de la lame de cuivre vers la lame de zinc : On a donc constitué un générateur électrochimique appelé pile
Le sens du courant indique que l’électrode par laquelle le courant sort est la borne positive (+) et l’électrode par laquelle le courant entre est la borne négative (-) de la pile.
3. Interprétation
a. Comment le courant se déplace-t-il ?
A l’extérieur de la pile et dans les électrodes, le courant passe dans les conducteurs métalliques. Les porteurs de charge sont les électrons : ils quittent l’électrode de zinc borne (-) et se dirigent vers l’électrode se cuivre borne (+).
A l’intérieur de la pile, dans les solutions et le pont salin, les porteurs de charge sont les ions. Les ions positifs se déplacent dans le sens du courant et les ions négatifs dans le sens contraire.
Le pont salin assure la fermeture du circuit électrique en évitant les solutions de se mélanger.
b. D’où proviennent les électrons ?
Ils sont fournis par la lame de zinc, borne (-) qui sera donc siège de la réaction suivante : Zn→ Zn2++ 2e-
On dit que la borne (-) est le siège d’une oxydation.
Lorsque les électrons arrivent à l’électrode de cuivre, borne (+), ils vont être consommés suivant la réaction : 2e- + Cu2+→ Cu
On dit que la borne (+) est le siège d’une réduction.
Dans la pile, l’oxydation et la réduction se produisent simultanément mais séparément.
II. Fonctionnement de la pile
Si le circuit extérieur est fermé, le fonctionnement de la pile correspond à l’échange d’électrons qui se produirait au cours d’une réaction chimique entre ces deux couples rédox.
Le réducteur du couple Zn2+/Zn cède des électrons et s’oxyde suivant :Zn→ Zn2++ 2e-
Les électrons sortent de la borne (-) Zn2+/Zn par le conducteur et circulent jusqu’à la borne(+) par laquelle ils entrent en contact avec l’oxydant du couple Cu2+/Cu. Dans le compartiment du couple Cu2+/Cu, se produit alors la réaction de réduction : 2e- + Cu2+→ Cu
Le pouvoir oxydant ou réducteur d’une espèce dépend du potentiel standard rédox du couple.
On peut caractériser chaque demi-pile par un potentiel appelé potentiel rédox du couple Mn+/M.
Comme le sens du courant est l’inverse du sens des électrons, dans un circuit alimenté par une pile.
La borne(+) de la pile est associée au couple dont le potentiel est le plus élevé, et la borne (-) est associée au couple dont le potentiel est le plus faible.
A la borne (+) dont le potentiel est le plus élevé au début, l’oxydant se réduit et le potentiel baisse, alors qu’à la borne (-) le réducteur s’oxyde et le potentiel augmente.
La pilefonctionnedonc débite du courant tant que les deux potentiels restent différents.
Cette variation de potentiel se produit jusqu’à l’équilibre qui marque la fin des échanges d’électrons et le fonctionnement de la pile.
III. Force électromotrice de la pile
La force électromotrice d’une pile est une grandeurpositive qui se mesure avant tout fonctionnement. Elle est égale à la différence des potentiels des deux couples.
f.e.m = E(+) - E(-)
Remarque : La f.e.m dépend de la concentration en ions métalliques dans les solutions de demi-pile.
IV. Equation bilan de la réaction de fonctionnement de la pile Daniel.
- Classons les deux couples rédox suivant le pouvoir oxydant croissant :
Cu2+ + Zn→Cu + Zn2+
Maintenant, écrivons les demi-équations rédox qui se déroulent aux électrodes :
La borne (+) siège d’une réduction : 2e- + Cu2+→ Cu
La borne (-) siège d’une oxydation :Zn→ Zn2++ 2e-
Puisécrivons l’équation bilan :Cu2+ + Zn→Cu + Zn2+
Que remarque-t-on ?
Les potentiels rédox permettent de prévoir la réaction entre deux couples.
V.
Comment se déplacent les ions 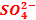 dans le pont ionique ?
dans le pont ionique ?
Dans la
demi-pile cuivre, les ions 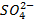 deviennent
excédentaires puisque les ions Cu2+ sont réduits, alors que dans la
demi-pile zinc, les ions
deviennent
excédentaires puisque les ions Cu2+ sont réduits, alors que dans la
demi-pile zinc, les ions 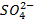 sont
déficitaires car des cations Zn2+ sont formés.
sont
déficitaires car des cations Zn2+ sont formés.
Or dans toute
solution l’équilibre électronique doit être respecté : les ions 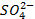 circulent
donc dans le pont ionique de la demi-pile cuivre vers la demi-pile zinc.
circulent
donc dans le pont ionique de la demi-pile cuivre vers la demi-pile zinc.
Bibliographie :
GRUIA M., POLISSET M. (1996), Chimie générale P.C.E.M, DEUG A et B, Pharmacie, Paris : Edition Marketing
« Électrochimie » Microsoft Encarta 2009[DVD].Microsoft Corporation, 2008.

CONCEPTEURS MEN